в помощь практикующему врачу-педиатру Полный доступ для зарегистрированных пользователей
«Умное» пищеварение — наше «нет» ФРП
Кишечная микробиота —
это не просто некий набор микроорганизмов, а полноценный участник оси «кишечник — мозг».
Кишечная микробиота — это не просто некий набор микроорганизмов, заселяющих главным образом толстый кишечник
ФРП — это устойчивые комплексы гастроинтестинальных симптомов, которые возникают в связи с нарушением моторики, висцеральной гиперчувствительностью, изменениями состояния мукозального иммунитета и воспалительного ответа в результате нарушения состава микробиоты и изменений регулирования «оси» кишечник — мозг7
В основе развития ФРП у младенцев лежит нарушение формирования кишечной микробиоты
Наличие тесных связей в оси «микробиота-кишечник-мозг» говорит о том, что развитие ЦНС неразрывно связано с развитием пищеварительной системы в целом и энтеральной нервной системы с микробиотой в частности. И лишь обеспечив хорошие условия для формирования взаимодействия в цепочке «микробиота-мозг», можно добиться и хорошей работы желудочно-кишечного тракта, и хорошего функционирования головного мозга

Как можно повлиять на формирование кишечной микробиоты и снизить риск ФРП у грудного ребенка?
-
Положительную роль может сыграть применение пробиотиков. Важно помнить, что оценка эффективности пробиотиков, особенно в педиатрической практике, должна основываться на принципах доказательной медицины
-
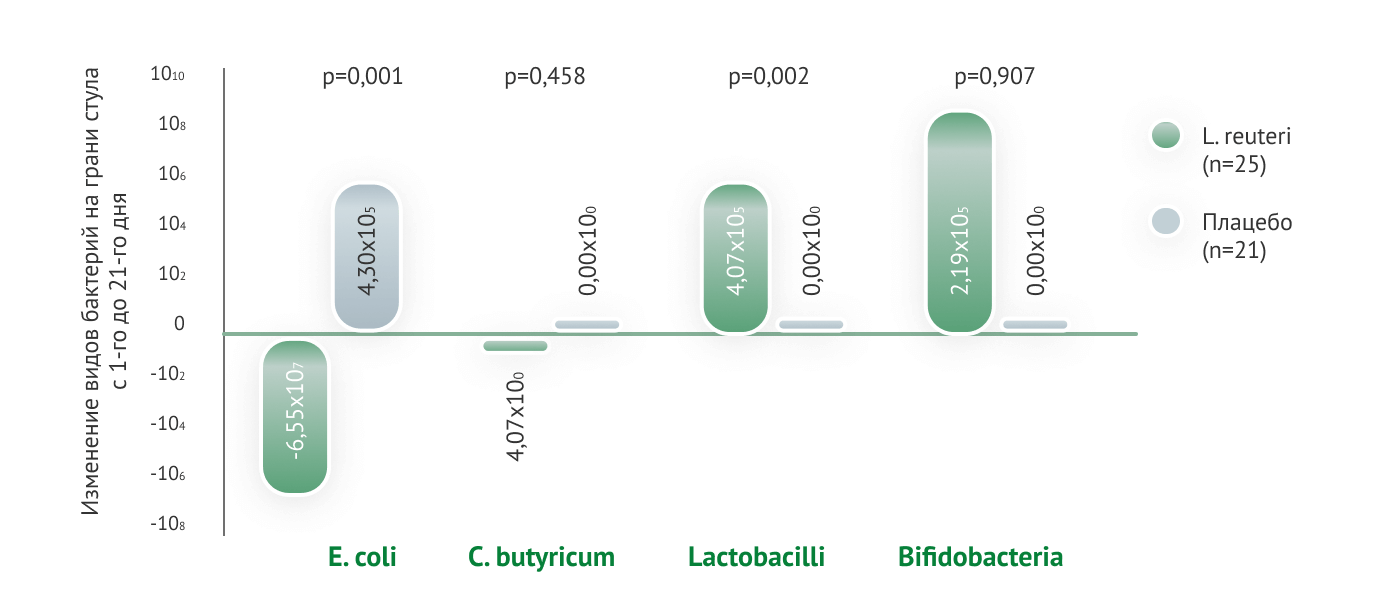
Одним из наиболее эффективных в плане профилактики ФРП пробиотиков является Lactobacillus reuteri DSM 17938
-
На основании результатов проведенных международных научных исследований штамму L. reuteri DSM 17938 присвоена степень доказательности 1а в отношении профилактики и 1b — в коррекции младенческих кишечных колик
Основные механизмы действия
Lactobacillus reuteri DSM 17938:

В случае отсутствия или недостатка грудного молока смесь Nestogen® с уникальным комплексом L. reuteri Plus может снизить риск формирования ФРП у младенцев21, а также способствовать формированию «умного» пищеварения благодаря важным компонентам19:
-
Lactobacillus reuteri DSM 17938 — профилактика ФРП, развитие энтеральной нервной системы
-
Лютеин — важный нутриент для развития органа зрения
-
Докозагексаеновая кислота — один из структурных и функциональных компонентов центральной нервной системы
-
Нуклеотиды — сложные биологические вещества, играющие важную роль во многих биологических процессах
-
Молочный жир — источник холестерина и жирных кислот
Nestogen®— «умное» пищеварение для здоровья ребенка сейчас и в будущем

1. Бондаренко В.М., Мацулевич Т.В. Дисбактериоз кишечника как клинико — лабораторный синдром: современное состояние проблемы. Москва: ГЭОТАР-Медиа 2007; 300
2. Boulangé C.L., Neves A.L., Chilloux J., Nicholson J.K., Dumas M. Impact of the gut microbiota on inflammation, obesity, and metabolic disease. Genome Medicine 2016; 8 (42): 1— 12. DOI: 10.1186/s13073-016-0303-2
3. Zhang Y., Zhang H. Microbiota associated with type 2 diabetes and its related complications. Food Science and Human Wellness 2013; 2: 167–172. DOI: 10.1016/ j.fshw.2013.09.002
4. Jose P.A., Raj D. Gut microbiota in hypertension. Curr Opin Nephrol Hypertens 2015; 24 (5): 403–409. DOI:10.1097/ MNH.00149
5. Kostic A.D., Xavier R.J., Gevers D. The microbiome in inflammatory bowel disease: current status and the future ahead. Gastroenterology 2014; 146 (6):1489—1499. DOI: 10.1053/j. gastro.2014.02.009
6. Lynch S.V. Gut Microbiota and Allergic Disease. Ann Am Thorac 2016; 13: 51–54. DOI: 10.1513/AnnalsATS.201507-451MG
7. Rhee SH, Pothoulakis C, Mayer EA. Principles and clinical implications of the brain-gut-enteric microbiota axis. Nat Rev Gastroenterol Hepatol. 2009;6(5):306—314. doi: 10.1038/ nrgastro.2009.35
8. Бондаренко В.М., Рябиченко Е.В. Кишечно-мозговая ось. Нейронные и иммуновоспалительные механизмы патологии мозга и кишечника // Журнал микробиологии, эпидемиологии и иммунобиологии. 2013. № 2.
9. Foster JA. Gut feelings: bacteria and the brain. Cerebrum. 2013 Jul 1;2013:9. PMID: 24116266; PMCID: PMC3788166
10. Hesla H.M., Stenius F., Jäderlund L., Nelson R., Engstrand L., Alm J. et al. Impact of lifestyle on the gut microbiota of healthy infants and their mothers—the ALADDIN birth cohort. Microbiol Ecol 2014; 90 (3):791—801. DOI: 10.1111/1574-6941.12434
11. Reuter G. The Lactobacillus and Bifidobacterium Microflora of the Human Intestine: Composition and Succession. Curr Issues Intest Microbiol, 2001, 2: 43-53.
12. Axelsson LT, Chung TC, Dobrogosz WJ, Lindgren SE. Production of a broad spectrum antimicrobial substance by Lactobacillus reuteri. MicrobEcol Health Dis, 1989, 2: 131-136
13. Savino, Francesco et al. «Lactobacillus reuteri DSM 17938 in Infantile Colic: A Randomized, Double-Blind, Placebo-Controlled Trial.» Pediatrics 126 (2010): e526 — e533.
14. Abrahamsson Т., Jakobsson T. et al. Intestinal microbiota in infants supplemented with the probiotic bacterium Lactobacillus reuteri. J Ped Gastroenterol Nutr 2005; 40(5):692. Abstract PN1-17
15. Wang Z, Wang L, Chen Z, Ma X, Yang X, Zhang J, et al. In vitro evaluation of swine-derived Lactobacillus reuteri: probiotic properties and effects on intestinal porcine epithelial cells challenged with enterotoxigenic Escherichia coli K88. J. Microbiol. Biotechnol. 2016; 26: 1018–1025
16. Gabriela Bergonzelli Degonda (Bussigny), Magali Faure (Forel), Nicole Kusy (Montet). Lactobacillus Reuteri DSM 17938 for the Development of the Enteric Nervous System Patent Application (Application #20140363409); EP20110196138 20111230; Dec 11, 2014.
17. Perez-Burgos A, Wang L, McVey Neufeld KA, Mao Y-K, Ahmadzair M, Janssen LJ, et al. The TRPV1 channel in rodents is a major target for antinociceptive effect of the probiotic Lactobacillus reuteri DSM 17938. J. Physiol. 2015; 593 (17): 3943–3957
18. Indrio F, Di Mauro A. et al. Prophylactic use of a probiotic in the prevention of colic, regurgitation, and functional constipation: a randomized clinical trial. JAMA Pediatr. 2014 Mar;168(3):228-33.
19. Скрипченко Н.В., Федорова Л.А. и др. Питание и развитие мозга: вклад в будущее или упущенные возможности? Педиатрия им Г.Н.Сперанского. 2020; 99(3):134-142
Авторизируйтесь с помощью электронной почты или телефона