Полный доступ для зарегистрированных пользователей
Полный доступ для зарегистрированных пользователей
О.К. Нетребенко
ПРОГРАММИРОВАНИЕ ПИТАНИЕМ (МЕТАБОЛИЧЕСКОЕ ПРОГРАММИРОВАНИЕ) НА РАННИХ ЭТАПАХ РАЗВИТИЯ
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития России, Москва
В статье авторы приводят современные данные литературы о влиянии состояния здоровья и питания беременной женщины на развитие и здоровье ребенка не только раннего возраста, но и в последующей жизни. Нарушения внутриутробного развития приводят в дальнейшем к увеличению риска развития ожирения, сердечно-сосудистых заболеваний (ишемическая болезнь сердца, артериальная гипертензия), сахарного диабета 2-го типа, метаболического синдрома и др. Влияние неблагоприятных факторов во время внутриутробного развития плода и в первые 24 месяца постнатальной жизни ребенка рассматривается с позиций концепции метаболического программирования. Представлены данные о роли недостаточного и избыточного питания во время беременности, а также в первые 2 года жизни младенца на дальнейшее состояние здоровья детей и подростков. Обсуждаются возможности профилактики патологического метаболического программирования.
Ключевые слова: внутриутробное развитие, питание беременной женщины и детей раннего возраста, метаболическое программирование, состояние здоровья, профилактика.
Контактная информация:
Нетребенко Ольга Константиновна — д.м.н., проф. каф. госпитальной педиатрии № 1
ГБОУ ВПО РНИМУ им. Н.И. Пирогова
Адрес: 117997 г. Москва, ул. Островитянова, 1 Тел.: (499) 725-70-00, E’mail: olga.netrebenko@ru.nestle.com Статья поступила 28.09.12, принята к печати 8.10.12.
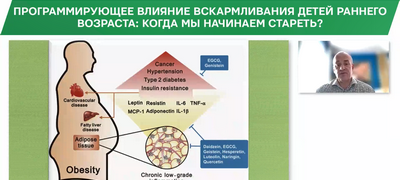
Проблемы состояния здоровья и продолжительности жизни россиян привлекают внимание широкой общественности и руководителей страны. Анализ структуры летальности населения по нозологическим единицам свидетельствует о высоком доминировании сердечно-сосудистых заболеваний (ССЗ), на которые приходится 56–57% всех случаев смерти граждан РФ. В большинстве случаев развитие сердечно-сосудистой патологии связано с избыточным весом и ожирением. ВОЗ констатирует, что ожирение — одна из наиболее очевидных, но игнорируемых обществом проблем здравоохранения. За последние 30 лет удвоилось число людей с ожирением и избыточным весом. В 2008 г. 1,5 млрд людей имели избыточный вес. В 2010 г. 43 млн детей имели избыточный вес и ожирение [1]. Причины высокой распространенности ССЗ и ожирения во всех развитых странах практически аналогичны. В них можно включить изменение характера питания, потребление обильной жирной пищи, снижение двигательной активности и многие другие факторы цивилизации. Однако среди всех хорошо известных причин ожирения и ССЗ стали более отчетливо видны скрытые причины, связанные с ранним периодом развития ребенка и формированием предрасположенности к социально-значимым заболеваниям.
Появились данные том, что первые 1000 дней существования человека определяют его здоровье, продолжительность жизни и что из этих 1000 дней первые 270 — период беременности — играют важную, зачастую основополагающую роль.
Многочисленные эпидемиологические и клинические исследования показывают, что нарушение внутриутробного роста увеличивает частоту развития ожирения, ишемической болезни сердца (ИБС), резистентности к инсулину (ИР) и ряда других заболеваний во взрослой жизни. Эти исследования и наблюдения позволили сформулировать концепцию о ранних истоках взрослых болезней. Склонность к формированию этих заболеваний является следствием нарушений внутриутробного окружения/питания, что часто сопровождается задержкой внутриутробного развития (ЗВУР). Процесс влияния неблагоприятных факторов на ранних критических этапах развития плода на состояние структуры ткани, органов и их функционирование получил название внутриутробного программирования [2].
Определение факторов внутриутробного программирования и оценка последствий их влияния помогут снизить отдаленные риски развития патологических процессов.
К настоящему времени достоверно установлено несколько факторов неблагоприятного внутриутробного программирования развития плода. Доказано, что недостаточное или избыточное питание беременной женщины, а также дефицит отдельных нутриентов программируют изменения метаболизма плода, которые увеличивают риск развития ССЗ, ожирения и ряда других заболеваний в дальнейшей жизни.
В понятие «недостаточное питание плода» включают дефицит белка, калорий, отдельных микронутриентов, а также гипоксию в процессе беременности, анемию.
Классическим примером влияния дефицита питания на процессы программирования явился голод в Голландии, имевший место зимой 1944— 1945 гг., когда на протяжении нескольких месяцев было нарушено снабжение населения продовольствием. Родившиеся после голодного времени дети имели снижение массы тела (МТ) и развивали впоследствии (в среднем к 50 годам) ожирение и ИР [3]. Первые доказательства важности внутриутробного питания на здоровье и продолжительность жизни человека появились почти 20 лет назад, когда D. Barker сопоставил МТ при рождении более 15 000 граждан Хертфордшира, родившихся в 1928–1935 гг., с летальностью от ИБС и нарушением толерантности к глюкозе или сахарным диабетом. Результаты исследования показали, что низкая МТ при рождении с высокой степенью достоверности увеличивала риск развития ССЗ и СД [4]. На протяжении последних 10 лет проведено множество исследований, подтверждающих эту гипотезу, однако точные механизмы такого влияния остаются неясными. Считается, что период внутриутробного и раннего постнатального развития характеризуется высокой биологической «пластичностью» всех метаболических систем организма, высокой чувствительностью к факторам окружающей среды, и нарушение питания матери, а также гипоксия, стресс, нарушение маточно-плацентарного кровообращения приводят к ЗВУР плода и, возможно, формируют так называемый «экономный фенотип», который в последующем способствует накоплению жировой ткани, нарушению липидного обмена и формированию метаболического синдрома (МС). Рост и МТ ребенка при рождении в соотношении со сроком гестации являются маркером адекватности внутриутробного питания.
По мнению P.D. Glukman и соавт. [5], ребенок, родившийся от неблагоприятно протекавшей беременности, прогнозирует внутриутробно неблагоприятную ситуацию после рождения, при этом организм выстраивает стратегию подготовки к выживанию: у детей — маленький рост, ранний пубертат, изменение гормональной оси, изменение поведения, увеличение резистентности к инсулину, склонность к накоплению жировой ткани. Какие механизмы действуют в этой ситуации?
Согласно теории «история жизни», при недостаточном поступлении энергии и других нутриентов в период внутриутробной жизни происходит перераспределение нутриентов в пользу наиболее важных для развития органов, прежде всего мозга [6]. При этом снижается поступление нутриентов к другим органам (печень, почки, поджелудочная железа), что приводит к снижению числа клеток и функциональных возможностей этих органов. Это означает, что у детей с малой МТ при рождении относительные размеры этих органов меньше по сравнению с размерами мозга, сердца, надпочечников [7].
B.M. Brenner и G.M. Chertow [8] первые предположили, что снижение числа нефронов у маловесных детей может увеличить риск артериальной гипертензии (АГ) и хронических болезней почек. Начиная с 2000 г., в медицинских журналах было опубликовано более 80 статей, в которых отмечалась обратная корреляция систолического артериального давления (САД) и МТ при рождении [9]. Известно, что нефрогенез начинается с 8-й недели гестации и наиболее активно проходит в 3-м триместре беременности. После 36-й недели гестации новые нефроны практически не образуются. Исследования материала аутопсий показало, что ЗВУР сопровождается снижением число нефронов у младенцев [10]. S. Bagby [11] высказала предположение, что при снижении числа нефронов избыточная прибавка МТ в постнатальном периоде создает дисбаланс, который генерирует развитие АГ. Клинические исследования показали, что САД у подростков обратно пропорционально МТ при рождении (рис. 1).
Недостаточное внутриутробное питание часто сопровождается повышением аппетита и избыточным отложением жира в постнатальном периоде. Однако, по мнению D. Barker и S. Bagby [9], ожирение не является обязательным компонентом ускоренного постнатального роста маловесных детей в постнатальном периоде, но его развитие вызывает дополнительные нарушения метаболизма. В то же время при повышенном потреблении пищи возникает ситуация, когда низкая экскреторная способность почек (при сниженном числе нефронов) недостаточна для таких нагрузок и приводит к еще большим нарушениям состояния нефронов (гипертрофии, увеличению давления в капиллярах гломерул, активации комплекса ренин/ангиотензин).
Дополнительным фактором развития АГ у взрослых, родившихся с малой МТ, является внутриутробное программирование чувствительности к глюкокортикоидам (ГК). В ряде экспериментальных исследований удалось установить, что нарушение питания во время беременности программирует у плода повышение экспрессии глюкокортикоидных и минералокортикоидных рецепторов с одновременным снижением активности фермента 11β-гидроксистероид дегидрогеназы, участвующего в метаболизме ГК [12]. Таким образом, формируется повышенная чувствительность к ГК и одновременное повышение их уровня в организме. Такие же данные получены при назначении дексаметазона в период беременности. Эти данные позволяют говорить, что существует несколько механизмов, увеличивающих риск развития АГ у человека, родившегося маловесным.
В целом ряде эпидемиологических исследований была продемонстрирована связь низкой МТ при рождении с риском развития СД 2-го типа (СД2) и ожирения во взрослом возрасте.

Известно, что самым значимым фактором риска развития СД2 является ожирение. Наблюдение за субъектами (10 000), родившимися в 1958 г. в Великобритании, показало, что к 41 году жизни было выявлено 88 случаев СД2, причем в большинстве случаев у субъектов с малой МТ при рождении и наиболее высоким индексом МТ (ИМТ) в возрасте 23 лет. Кроме того, было установлено, что у детей с наиболее высоким ИМТ в возрасте 7 лет отмечался также высокий ИМТ и в возрасте 23 лет. Таким образом, это было первое контролируемое исследование, которое показало, что рождение с малой МТ и последующим ускоренным ростом является фактором риска развития избыточной МТ и СД2 [13].
Экспериментальные исследования на животных показали, что снижение уровня белка и калорийности рациона в период беременности, а также искусственная внутриутробная гипоксия приводят к одинаковым результатам: снижению числа β-клеток поджелудочной железы и развитию инсулинрезистентного СД в дальнейшем [14]. Несмотря на то, что потомство этих животных в постнатальном периоде восстанавливало свою МТ (и вес поджелудочной железы), все равно во взрослом возрасте у этих животных наблюдалось снижение количества β-клеток и развитие ИР. В некоторых моделях (гипоксия и ограничение белка) не выявлено нарушения состояния и общей массы β-клеток до 7-й недели постнатальной жизни, далее наблюдалось снижение массы β-клеток до 50% по сравнению с контрольной группой.
Молекулярные механизмы этого явления связаны с нарушением экспрессии основных генов, регулирующих адекватное развитие клеток поджелудочной железы (Pdx1) и генов транспортеров глюкозы (Glut4), а также снижением васкуляризации островков Лангерганса и хроническим повышением уровня свободных радикалов в тканях поджелудочной железы. В модели ограничения калорийности рациона в период беременности уже у новорожденных животных наблюдалось снижение МТ, массы поджелудочной железы, содержания инсулина и плотности островков Лангерганса и массы β-клеток [15]. Интересно отметить, что в этой модели наблюдалось повышение уровня ГК в сыворотке крови плода, что, возможно, и является биохимическим механизмом выявленных нарушений, так как уже было показано, что повышение уровня ГК нарушает нормальную дифференциацию β-клеток и снижает экспрессию Pdx1 [16, 17]. Во все моделях животных наблюдалось нарушение толерантности к глюкозе, склонность к развитию ожирения и МС.

Чувствительность к инсулину клеток органов-мишеней (печень, мышечная ткань, жировая ткань) весьма вариабельна. Однако в большинстве случаев снижение чувствительности к инсулину компенсируется усилением работы панкреатических β-клеток. В случаях внутриутробного нарушения количества и функциональных возможностей β-клеток нарушается толерантность к глюкозе [18].
Гипоксия плода вызывает специфические нарушения в сердечно-сосудистой системе. Гистологические исследования продемонстрировали, что именно сердце является органом, наиболее чувствительным к гипоксии. Экспериментальные исследования показывают, что гипоксия в период беременности вызывает снижение пролиферации клеток миокарда, что приводит к снижению толщины сердечной мышцы. Первый морфологический дефект, связанный с гипоксией плода — разная степень отслоения эпикарда от сердечной мышцы, причем распространенность этого дефекта прямо коррелирует с тяжестью гипоксии [19].
В клинических исследованиях новорожденных детей со ЗВУР было выявлено достоверное увеличение толщины аорты, что, по данным исследователей, увеличивает риск ССЗ во взрослой жизни [20] (рис. 2).
Исследование M. Mortaz и соавт. [21] позволяет понять некоторые дополнительные механизмы развития ССЗ, ожирения и МС у детей, рожденных с малой МТ. Анализ липидного профиля детей в возрасте 8–12 лет, рожденных с МТ менее 1850 г, показал повышение эндогенного синтеза холестерина и снижение эффективности его абсорбции. В исследовании также отмечено, что максимальные нарушения наблюдались у детей со ЗВУР и ускоренным постнатальным ростом. По экспериментальным данным Z. Yates и соавт. [22], снижение потребления белка в период беременности программирует метаболизм и транспорт холестерина у потомства. Эти метаболические изменения напрямую связаны с формированием атеросклеротических изменений, в частности, с более обширными атеросклеротическими повреждениями в аорте, что является доказательством прямого программирования ССЗ, а не только факторов риска.
Ожирение у женщин фертильного возраста является серьезной проблемой всех развитых стран. Ожирение в период беременности увеличивает риск невынашивания, эклампсии и гестационного диабета (ГД) [23, 24]. Эти осложнения увеличивают, в свою очередь, риск неблагоприятного программирования метаболизма плода с развитием избыточной жировой ткани и снижением чувствительности к инсулину [25]. По некоторым данным, в развитых странах до 30% беременностей осложнены ожирением или избыточным весом. По данным Р. Catalano и соавт. [26], оценка резистентности к инсулину у беременной и плода с использование индекса HOMA-IR показала достоверно более высокие показатели индекса у плодов женщин с ожирением. Авторы приводят возможный механизм действия ожирения и СД на процесс накопления жира в адипоцитах плода (рис. 3).
По мнению некоторых исследователей, высокая МТ при рождении является более значимым фактором развития гиперинсулинемии и резистентности к инсулину, чем рождение с малым весом [27].
Увеличение частоты случаев ожирения у беременных женщин сопровождается ростом случаев макросомии плода и новорожденного и ранним развитием избыточной МТ (в первые полгода жизни) у младенца [24]. Ожирение до и во время беременности является существенным фактором риска развития ожирения у потомства. Механизм влияния избыточного веса беременной на метаболический статус плода можно представить как избыточное питание плода: ожирение и избыточное питание


беременной женщины увеличивают уровень глюкозы и инсулина у плода, далее увеличиваются синтез лептина и его секреция адипоцитами плода, что, в свою очередь, еще больше повышает уровень глюкозы, инсулина, лептина и модулирует метаболический ответ нейронов гипоталамуса с развитием макросомии плода и новорожденного и программирует рост ИМТ у потомства [28]. Дополнительный вклад в программирование метаболизма плода и новорожденного привносит нарушение липидного обмена и другие метаболические нарушения, присущие течению ожирения.
Ожирение, как известно, сопровождается процессами хронического воспаления. У беременных женщин с ожирением выявлено повышение продукции провоспалительных цитокинов и других показателей хронического воспаления. У плодов матерей с ожирением выявлена тенденция к повышению уровня СРБ и достоверно более высокий уровень ИЛ6 и лептина [29] (рис. 4).
В последние годы появились интересные экспериментальные данные, связывающие высокожировой рацион в период беременности с состоянием работы гипофизарно-гипоталамической системы. В работе G. Chang и соавт. [30] показано, что высокожировой рацион в период беременности программирует у плода пролиферацию гипоталамических пептид-продуцирующих (галанин, энкефалин и др.) нейронов, увеличивающих риск развития избыточного веса и ожирения.
Следует отметить, что программирующим влиянием обладает также высокая прибавка в весе у здоровых женщин с адекватным ИМТ и рождением крупного плода. Есть доказательства того, что рождение крупного младенца вне зависимости от ИМТ матери и наличия ГД увеличивает у него риск развития МС к 5-летнему возрасту, причем большее значение имеет рождение детей с крупным весом даже без ГД у матери [31].
Существует значительное количество доказательств того, что влияние ожирения в период беременности на потомство выходит далеко за пределы периода младенчества, увеличивая риск ожирения и проблем со здоровьем у потомства во взрослом возрасте. Полученные данные позволяют говорить, что ожирение в период беременности создает значительный риск развития разнообразных метаболических нарушений у потомства и, таким образом, влияет на состояние здоровья следующего поколения [6, 26].
Особый интерес исследователей направлен на изучение влияния потребления белка на развитие плода и новорожденного. Мы уже упоминали влияние ограниченного поступления белка, развитие ЗВУР на дальнейшее состояние здоровья ребенка и взрослого человека. Имеет ли значение поступление избыточного количества белка в период беременности?
Есть несколько экспериментальных исследований в этом направлении с противоречивыми результатами. Так, по данным С. Rehfeldt и соавт. [32], у новорожденных свинок от беременности, протекавшей с избыточным потреблением белка, отмечалась меньшая МТ по сравнению с контрольной группой. По другим данным, характер влияния высокобелковой диеты в период беременности зависит от пола потомства. У особей женского пола, родившихся от беременности с высоким потреблением белка, отмечается более высокое отложение жира в постнатальном периоде, у особей мужского пола — АГ с симптомами гломерулосклероза [33]. Эпидемиологическое исследование, проведенное в Австралии, показало, что у детей от беременности, протекавшей с повышенным потреблением белка, наблюдается более низкий пондеральный индекс при рождении [34].
Особый интерес вызывают исследования влияния современного молодежного рациона «мусорной» пищи (junk-food), содержащего высокий уровень насыщенных жиров и сахара в период беременности на потомство. Экспериментальные исследования показывают, что рацион junk-food во время беременности формирует предпочтение такой пищи у потомства, причем программирование связано с изменением экспрессии ряда опиоидных рецепторов [35]. Дополнительным неблагоприятным фактором рациона «кафетерия» (высокое содержание насыщенных жиров и сахара) является изменение характера кишечной микробиоты со снижением уровня бифидобактерий и лактобацилл, что влечет за собой снижение уровня этих бактерий в кишечнике младенца. Кроме того, есть экспериментальные данные, показывающие, что рацион junk-food во время беременности способствует гиперфагии, избыточному отложению жира и снижению тощей МТ, в частности атрофии мышечной ткани со снижением ее функции [36].
Таким образом, характер питания беременной женщины существенным образом влияет на состояние здоровья, продолжительность жизни и качество жизни потомства. И избыточное, и недостаточное питание может программировать развитие ожирения, ССЗ и СД2 у подростков и взрослых.
Первые 24 месяца жизни ребенка являются практически таким же «пластичным» критическим периодом развития, как и внутриутробный период. Характер питания после рождения может либо снизить риск заложенных внутриутробно проблем, либо их увеличить.
Ярким примером сочетанного влияния внутриутробного и постнатального питания на метаболический профиль новорожденного является экспериментальная работа K. Page и соавт. [37], которые оценивали состояние здоровья и метаболизм потомства после стандартной беременности и беременности, протекавшей с избыточным потреблением жира, а также избыточным питанием в постнатальном периоде. Результаты исследований показали, что высокожировой рацион в период беременности приводит к увеличению уровня инсулина, лептина, кортизола, глюкозы у потомства; в случае сохранения высокожирового рациона в период введения прикорма эти нарушения сохранялись, а также отмечалось изменение экспрессии генов, ответственных за синтез рецепторов лептина и нейропептида V (рис. 5). Эти нарушения сохранялись на протяжении всей жизни животных и приводили к развитию ожирения, СД и снижали продолжительность жизни.
Четким показателем избыточного питания является скорость роста ребенка, особенно в первые месяцы жизни. Младенчество является периодом наиболее быстрого роста и развития нейрокогнитивных, моторных и социальных функций. Некоторые исследователи считают, что скорость роста в младенчестве может прогнозировать ожирение в дальнейшей жизни. J. Baird и cоавт. [38] провели системный анализ 10 исследований, которые оценивали рост ребенка в отношении последующего ожирения. Относительный риск ожирения варьировал от 1,17 до 5,7% у детей с максимально быстрой скоростью роста на первом году жизни.
Анализ характера роста детей во Франции показал, что прибавка веса в возрасте от 3 до 6 месяцев жизни являлась прогностическим фактором увеличения жировой МТ в подростковом возрасте [39]. Долговременное исследование в Швеции показало, что скорость роста в возрасте от рождения до 6 месяцев жизни являлась прогностическим фактором не только для ожирения, но и для МС. Дети с наибольшей прибавкой в весе в первые 6 месяцев жизни в возрасте 17 лет достоверно чаще имели больший объем висцерального жира, более высокое АД, более высокий уровень

триглицеридов в крови и признаки ИР [40] (рис. 6). Анализ факторов, увеличивающих скорость роста, проведенный М.F. Rоlland-Cachera и соавт. [41], показал корреляцию скорости роста в младенчестве с уровнем потребления белка: дети с наибольшим уровнем белка в рационе имели наибольшую скорость роста. Предполагают, что высокий уровень белка в рационе младенца приводит


к увеличению концентрации инсулиногенных аминокислот в плазме крови, которые стимулируют продукцию инсулина и инсулиноподобного фактора роста (IGF-1). Оба гормона обладают адипогенным действием. Мультицентровое исследование группы европейских ученых, проведенное в 5 европейских странах, показало, что снижение уровня белка в детской смеси до 12 г/л достоверно снижает концентрацию инсулиногенных аминокислот в плазме крови у детей, а также продукцию IGF-1 и инсулина (рис. 7). Использование смеси со сниженным уровнем белка позволило снизить число детей с избыточным весом и ожирением к 7-летнему возрасту [42].
Это исследование — одно из первых, которое показало возможности предотвращения развития ожирения у детей с помощью изменения уровня белка в рационе младенца.
В медицинской литературе широко обсуждается возможность изменения внутриутробного и постнатального программирования. С учетом широкого распространения ожирения в мире и многочисленными его осложнениями, очевидно, что необходимо искать пути предотвращения развития этого заболевания на самых ранних этапах развития [43].
Одной из наиболее изученных экспериментальных работ программирования во внутриутробном периоде является использование животной модели с ограниченным поступлением белка. Одним из вариантов репрограммирования в этой модели было обогащение рациона беременной самки донаторами метильных групп, такими как фолиевая кислота, холин, и некоторых микронутриентов — цинк, витамины В12, В6. Включение в рацион этих микронутриентов позволило изменить некоторые процессы программирования, в частности, предотвратить эпигенетическую модификацию экспрессии генов печени у потомства. Эффект неблагоприятного действия ГК в экспериментальных исследованиях можно было снизить или предотвратить благодаря включению в рацион беременной или потомства высокого количества ω-3 жирных кислот [12].
Еще одним возможным способом снижения риска развития ожирения является модификация кишечной микробиоты (КМБ). В последние годы все больше дискутируется вопрос о роли КМБ в развитии ожирения. Анализ состава КМБ у беременных с ожирением показал, что у женщин с нормальным ИМТ был достоверно более высокий уровень бифидобактерий и бактероидов по сравнению с группой женщин с избыточным весом и сниженный уровень энтеробактерий, стафилококка и кишечной палочки (рис. 8) [44]. По данным M.C. Collado и соавт. [45], ИМТ женщин коррелировал с повышенным количеством клостридий, бактероидов и стафилококков, их количество нарастало к Ш триместру беременности. При этом количество бифидобактерий у женщин с избыточным весом было ниже, чем у стройных. Поскольку первичная колонизация кишечника новорожденных происходит под влиянием кишечной, вагинальной, кожной флоры матери и грудного молока, которое содержит штаммы бактерий, транслоцированные из кишечника матери, состав материнской КМБ может оказывать влияние на формирование КМБ ребенка.
В глобальном масштабе процессы программирования ожирения можно предотвратить изменением образа жизни и характера питания детей дошкольного и школьного возраста.
Говоря о питании беременных женщин, следует отметить, что неблагоприятное влияние на плод у женщин с ожирением, СД, избыточной прибавкой веса можно уменьшить при использовании в питании пробиотиков и ω-3 жирных кислот. В ряде работ представлено благоприятное действие пробиотиков на предупреждение ожирения и развитие иммунитета и положительное системное воздействие на другие органы и системы организма, и именно это позволяют рекомендовать включение пробиотиков в рацион беременной женщины.

Использование продуктов, обогащенных пробиотиками, является приоритетным перед лекарственными формами, так как профилактическое действие и профилактические дозы связаны именно с этими продуктами. Одним из новых продуктов, содержащих основательно изученные пробиотики — L. rhamnosus и B. lactis, является молочный напиток для беременных и кормящих женщин «Мама и Я», разработанный в научноисследовательском центре Нестле.
1. WHO: Obesity and overweight. http://www.who.int/ entity/gho/ncd/risk_factors/overweight/en/
2. Fowden A, Giussani D, Forhead A. Intrauterine programming of physiological systems: causes and consequences. Physiology. 2006; 21: 29–37.
3. Roseboom T, van der Meulen J, Osmond C, et al. Plasma lipid profiles in adults after prenatal exposure to the Dutch famine. Am. J. Clin. Nutr. 2000; 5: 1101–1106.
4. Barker DJP. Human growth and cardiovascular disease. In: NNW Pediatric program Window of Opportunity: PrePregnancy to 24 Months of Age. 2007; 61: 21–38.
5. Gluckman PD, Hanson MA, Low FM. The role of developmental plasticity and epigenetics in human health. Birth. Defects Res. Part C: Embrio Today. 2011; 93: 12–18.
6. Barker DJP, Gluckman PD, Godfrey KM, et al. Fetal nutrition and cardiovascular disease in adult life. Lancet. 1993; 341: 938–941.
7. Wollmann HA. Intrauterine growth restriction: Definition and etiology. Horm. Res. 1998; 49 (Suppl. 2): 1–6.
8. Brenner BM, Chertow GM. Congenital oligonephropathy and the etiology of adult hypertension and progressive renal injury. Am. J. Kidney Dis. 1994; 23: 171–175.
9. Barker D, Bagby S. Developmental antecedents of cardiovascular disease: a historical perspective. J. Am. Soc. Nephrol. 2005; 15: 2537–2544.
10. Puddu M, Fanos V, Podda F, et al. The kidney from prenatal to adult life: perinatal programming and reduction of number of nephrons during development. Am. J. Nephrology. 2009; 30: 162–170.
11. Bagby S. Maternal nutrition, low nephron number, and hypertension in later life: pathways of nutritional programming. J. Nutr. 2007; 137: 1066–1072.
12. Wyrwoll C, Mark P, Brendan J, et al. Developmental programming of renal glucocorticoid sensitivity and the renninangiotensin system. Hypertension. 2007; 50: 579–594.
13. Hyponen E, Power C, Smith G. Prenatal growth, BMI and risk of type 2 diabetes by early midlife. Diabetes. 2003; 26: 2512–2517.
14. Portha B, Chavey A, Movassat K. Early-life origins of type 2 diabetes: fetal programming of beta-cells mass. Experimental Diabetes Res. 2011; article ID 105076: 16.
15. Green A, Rozance P, Limesand S. Consequences of a compromised intrauterine environment on islet function. J. Endocrin. 2010; 205: 211–224.
16. Pinney S, Simmons R. Epigenetic mechanism in the development of type 2 diabetes. Trends Endocrinol. Metab. 2010; 21 (4): 223–229.
17. Gesina E, Blondeau B, Milet A, et al. Glucocorticoid signaling affects pancreatic development through both direct and indirect effects. Diabetologia. 2006; 49: 2939–2947.
18. Yuan Q, Chen L, Liu C, et al. Postnatal pancreatic islet β cell function and insulin sensitivity at different stages pf lifetime in rats born with intrauterine growth retardation. PPOS one. 2011; 6 (10): e25167—e25174.
19. Ream M, Ray A, Chandra R, et al. Early fetal hypoxia leads to growth restriction and miocardia thinning. Am. J. Physiol. Regul. Comp. Physiol. 2008; 295 (2): R583—R595.
20. Koklu E, Ozturk M, Kurtoglu S, et al. Aortic intimamedia thickness, serum IGF-1, IGF-3 and leptin levels in intrauterine growth-restricted newborns of healthy mothers. Ped. Research. 2007; 62 (6): 704–709.
21. Mortaz M, Fewtrell M, Cole T, Lucas A. Birth weight, subsequent growth, and cholesterol metabolism in children 8-12 years old born preterm. Arch. Dis. Child. 2001; 84: 212–217.
22. Yates Z, Tarling E, Langley-Evans S, et al. Maternal undernutrition programmes atherosclerosis in the Apo E*3 Leiden mouse. Br. J. Nutr. 2009; 101 (8): 1185–1194.
23. Davies GA, Maxwell C, McLeid L, et al. Obesity in pregnancy. J. Obestet. Gynecol. Can. 2010; 32 (2): 165–173.
24. Surkan PJ, Forman MR, Michels KB. Reasons for increasing trends in large for gestational age births. Obstetrics and Gynecology. 2004; 104: 720–726.
25. Drake AJ, Reynolds RM. Impact of maternal obesity on offspring obesity and cardiometabolic risk. Reproduction. 2010; 140: 387–398.
26. Catalano P, Minum J, Presley L, et al. Fetuses of obese mothers develop insulin resistance in utero. Diabetes Care. 2009; 32: 1076–1080.
27. Simenthal-Mendia L, Castaneda A, Rodrigues-Moran M, et al. Birth-weight, insulin level and HOMA-IR in newborns at term. BMC Pediatrics. 2012; 12: 94–99.
28. Sirimi N, Goulis D. Obesity in pregnancy. Hormones. 2010; 9 (4): 299–306.
29. Basu S, Haghiac M, Surface P, et al. Pregravid obesity associates with increased maternal endotoxemia and metabolic inflammation. Obesity. 2011; 19: 476–482.
30. Chang G, Gaysinskaya V, Karataev O, et al. Materna high-fat diet and fetal programming: increased proliferation of hypothalamic peptide-producing neurons that increase risk for overeating and obesity. J. Neurosci. 2008; 28 (46): 12107— 12119.
31. Boney C, Verma A, Tucker R, et al. Metabolic syndrome in childhood: association with birth weight, maternal obesity, and gestational diabetes mellitus. Pediatrics. 2005; 115 (3): e290—e296.
32. Rehfeldt C, Lang I, Gors S, et al. Limited and excess dietary protein during gestation affects growth and compositional traits in gilts and impairs offspring fetal growth. J. Animal. Sci. 2011; 89: 329–341.
33. Thone-Reineke C, Kalk P, Klaus S, et al. High protein nutrition during pregnancy and lactation programs blood pressure, food efficiency, and body weight of the offspring in sexdependent manner. Am. J. Physiol. Integr. Comp. Physiol. 2006; 291: R1025—R1030.
34. Andreasyan K, Ponsonby AL, Dwyer T, et al. Higher maternal dietary protein intake in late pregnancy is associated with a lower infant ponderal index at birth. Eur. J. Clin. Nutr. 2008; 61: 498–508.
35. Ong Z, Muhihausler B. Maternal «junk food» feeding in rats dams alters food choices and development of mesolimbic reward pathway in the offspring. FASEB J. 2011; 25 (7): 2167–2179.
36. Bayol S, Macharia R, Farrington S. Evidence that a maternal «junk food» diet during pregnancy and lactation can reduce muscle force in offspring. Eur. J. Nutr. 2009; 48: 62–66.
37. Page K, Malik R., Ripple J, et al. Maternal and postweaning diet interaction alters hypothalamic gene expression and modulates response to high-fat diet in male offspring. Am. J. Physiol. Regul. Integr. Physiol. 2009; 297: R1049—R1057.
38. Baird J, Fisher D, Lucas P, et al. Being big or growing fast: systematic review of size and growth in infancy and later obesity. BMJ. 2005; 331: 924–934.
39. Botton J, Heude B, Maccario J, et al. Postnatal weight and height growth velocities at different ages between birth and 5 years and body composition in adolescent boys and girls. Am. J. Clin. Nutr. 2008; 87 (6): 1760–1768.
40. Ekelund U, Ong K, Linne Y, et al. Association of weight gain in infancy and early childhood with metabolic risk in young adults. J. Clin. Endocrinol. Metab. 2007; 92: 98–103.
41. Rolland-Cachera MF, Deheeger M, Akrout M, et al. Influence of macronutrients on adiposity development: a follow up study of nutrition and growth from 10 months to 8 years of age. Int. J. Obes. Relat. Metab. Disord. 1995; 19 ( 8): 573–578.
42. Socha P, Grote V, Gruszfeld D, et al. Milk protein intake, the metabolic-endocrine response and growth in infancy: data from a randomized clinical trial. Am. J. Clin. Nutr. 2011; 94 (6) (Suppl. 1): 17765S—17845S.
43. Vickers M, Sloboda D. Strategies for reversing the effect of metabolic disorders induced as consequence of developmental programming. Frontiers in Physiol. 2012; 3 (242): 1–11.
44. Santacruz A, Collado M, Garcia-Valdes L, et al. Gut microbiota composition is associated with body weight, weight gain and biochemical parameters in pregnant women. Br. J. Nutrition. 2010; 104: 83–92.
45. Collado MC, Isolauri E, Laitinen K. Distinct composition of gut microbiota during pregnancy in overweight and normalweight women. Am. J. Clin. Nutr. 2008; 88: 894–899.
А. Шаафсма, С.Г. Грибакин, Т.И. Гаранкина, А.А. Давыдовская
ЗНАЧЕНИЕ ОПТИМАЛЬНОГО ПЕРЕВАРИВАНИЯ БЕЛКА ДЛЯ ПОВЫШЕНИЯ ЕГО ПИЩЕВОЙ ЦЕННОСТИ, ФОРМИРОВАНИЯ ПОЛЕЗНОЙ КИШЕЧНОЙ МИКРОФЛОРЫ И УМЕНЬШЕНИЯ СЕНСИБИЛИЗАЦИИ ИММУННОЙ СИСТЕМЫКомпания «ФризлендКампина», Москва
Проблема переносимости детских молочных смесей (ДМС) хорошо знакома каждому практикующему педиатру. Несмотря на сходство состава, различные ДМС переносятся по-разному. Объяснение этого факта следует искать в особенности технологических процессов, в т.ч. в степени денатурации белка при термической обработке. В статье рассматриваются механизмы денатурации белков, от которых зависят не только показатели переносимости ДМС, но и степень предрасположенности к аллергическим реакциям.
Ключевые слова: детское питание, переносимость, пищевая аллергия, денатурация белка.
Контактная информация:
Грибакин Сергей Германович — д.м.н., проф., научный консультант компании «ФризлендКампина»
Адрес: 115320 г. Москва, Варшавское шоссе, 42, стр. 3
Тел.: (495) 775-25-08, E’mail: gribakin@anika-ru.ru
Статья поступила 12.12.12, принята к печати 17.12.12.
Физиологическое пищеварение — это довольно сложный процесс, в котором сочетаются как скорость эвакуации пищи из желудка, так и процессы переваривания и всасывания в тонкой кишке, и особенности формирования и ферментативной активности кишечной микробиоты (КМБ) в толстой кишке [1–3].
За последние несколько лет проведены два крупномасштабных социологических исследования, целью которых было сравнительное изучение переносимости наиболее известных марок детских молочных смесей (ДМС). Такие исследования были выполнены в ряде европейских стран и основаны на подробном анкетировании, как медицинских работников, так и родителей. Врачи и родители ответили на ряд вопросов о том, как переносится ребенком та или иная ДМС, как часто кормление той или иной смесью сопровождается наличием срыгиваний, кишечных колик, функциональных запоров или разжиженного стула. Иными словами, насколько успешно различные ДМС перевариваются и усваиваются (что по-английски можно выразить кратко: «easy in, easy out»).
Наш сайт в формате приложения всегда под рукой!
Нажмите на кнопку ниже и запустите установку приложения на следующей странице. При первом входе приложение запросит у вас разрешение на уведомления. Пожалуйста, нажмите «Да», если разрешаете приложению Nestle Baby&me Medical отправлять рекламные и информационные уведомления.
НачатьПриложение запросит у вас разрешение на уведомления. Пожалуйста, нажмите «Да», если разрешаете приложению Nestle Baby&me Medical отправлять рекламные и информационные уведомления.
Хорошо- 1. Нажмите на значок «Поделиться», он находится рядом с адресной строкой.
- 2. Выберите «Добавить на главный экран» и нажмите «Добавить».
АЛГОРИТМ
со срыгиваниями